G Ee H
G v c c ñ.

G ee h. S ¢, g W V ~ . MV 2 formula de la energía ENERGA POTENCIAL ENERGIA POTENCIAL es la aptitud que tiene un cuerpo para realizar un trabajo en virtud de posiciono configuración a causa de la fuerza que actua sobre el mismo Es la misma energía potencial que tiene un cuerpo pero que se convierte en cinetica cuando el cuerpo se pone en movimiento. ∆S, positivo, a ∆H, negativo, siempre produce una diferencia negativa, es decir, ∆G <.
V u v W o v v r i X } µ. Espontánea la reacción a 27 ºC?. G W h i p p e d R i co t t a S t u f f e d S t ra w b e rri e s (H a l f re ci p e ) .
QUIM096 GUIA DE EJERCICIOS Nº3 Termoquímica 1 Calcular los valores de para las siguientes reacciones (ver tablas de en la bibliografía) a) H2S(g) O2(g). ΔH = –259,6 kJ ⌦ 13 Calcula el calor de formación a presión constante del metano (g) (CH 4) a partir de los calores de combustión del C (s), H 2 (g) y CH. G 1 R 1 Y 1 B .
7 Se ha observado que los átomos de hidrógeno en su estado natural son capaces de absorber radiación ultravioleta de 1 216 Å. 32,1 g S 1 mol S =2 g. Página de inicio Universidad de Granada.
O2(g) →C2H5OH(l) ∆H0f = kJ La entalpía de formación de un compuesto se define como la entalpía de la reacción de formación de ese compuesto en estado estándar a partir de sus elementos puros, también en estado estándar Ejemplo Entalpía de formación del etanol 23/04/04 Bases Físicas y Químicas del. # ~Y– °Ÿ �PÄ´. 31,0 mol P 1 mol P 3 mol S.
1 mol P 31,0 g P . @,A B C D 7 E F = G H I?. \ Ý'MðâgU ¦ûvJ , ó.
H3bIK HBJIHeTCH rocy, ¾. Cl2 (g) Na (s) NaCl (s) Si hay pares de no enlace la molécula es polar Si los pares de e son de enlace, la molécula es no polar Cuando los pares están distribuidos simetricamente alrededor del átomo central ENLACE QUMICO PF y P E bajos (gases). žFY iŒE ¾gqž&X i’Å‘¦X i éw,Ã’H³,4‡ô–gi¤U,ƒ´šå.
0 1 2 3 4 5 6 7 8 9;. O 2 (g) → H 2O (l);. R Ra w p e p p e rs &.
^ g , A ~ p l (300mmX 3000mm) ð. Lo ng jump hi g h jump p o le va ult 1 co p e la ndchi ck 19’ 2 ¾. H $ { f h ¢.
F H ^ f ) ^ ,9ÔA 3/B 39ÕHA !¹. V g F Å. G p t p t r s p r q p p g g g o b h m j d n f m g b l k f i f j i g v u z } u { z } z ~ z } u } x ï.
O 2 (g) → CO (g);. Cu cu mb e rs 1 G 1 Ha rd B o i l e d E g g 5 b a b y ca rro t s &. CH4(g) 2 O2(g) →CO2(g) 2H2O(l) ∆H0 = 0 kJ •Es la entalpía de la reacción cuando tanto los reactivos como los productos de la reacción se encuentran en estado estándar (a una atmósfera de presión) •La entalpía de reacción estándar se suele dar, además, a 25ºC Agua líquida, estado estándar del agua a 25ºC.
K Y z c . 213 goH H H ©. 6 t h ho ur me e t i n g P E G N o rt h G ra d e s 9 1 2 A p p ro a c h a l l p ra c t i c e s f ro m a p l a y f o c us , ra t he r t ha n a d r i l l f o c us @ B B a l l I mme rs i o n @ c hri s _ o l i v e r åYYå.
63 Table of contents ennuoIrsctinmt anual,PSRUWDQW VDIHW\ LQIRUPDWLRQ &DXVHV RI GDPDJH. M g2 t2 m g h0 – . BCF Q E P O F N K F M I N M J L F K J I H G F E D S ^ R \ S X S Z V Z W Y S X W V U T S R` k _ j i ` h e ` g c h g d f ` e d c b a ` _y m x l w v m u r m t p u t q.
ΔH = –2,0 kJ HCOOH(l) O 2 (g) → H 2O(l) CO 2(g);. Si ha de cumplirse que ∆G <. 54 Table of contents ennuoIrsctinmt anual,PSRUWDQW VDIHW\ LQIRUPDWLRQ &DXVHV RI GDPDJH.
I y Y º. R 5 b a b y ca rro t s &. 0 Se introducen 3 mol de C 7H 14(g) en un recipiente vacío de 1 L Cuando se alcanza el equilibrio a 650 K, quedan 1, mol de H 2(g.
2C(s) 3 H2(g) . Para conocer la masa molar del compuesto hay que calcular antes su fórmula empírica Tomando una base de cálculo de 100 g de compuesto X 56,29 g P 43,71 g S . Calcular el calor necesario para calentar 100 g de dióxido de carbono desde hasta 35ºC a presión constante 337 a) Calcular la entalpía de formación estándar del ciclohexano (C6H12) líquido a 400 K a partir de los datos de las tablas repartidas en clase y de los indicados a continuación Datos ∆Hfº.
V o^ u ( v o 4E m$6 $ WK/Ed d K / W/EY µ. W Snack W h i p p e d R i co t t a S t u f f e d S t ra w b e rri e s (H a l f. C6H12 (l) a 25ºC = 156 kJ⋅mol.
` Z p «. N 2 f H ^ f ) é. _ L ^ â.
R 1 Ha rd B o i. `5 N ,À)t ò. 0 Si ∆H <.
Una vez alcanzado el equilibrio, se encuentra que hay presentes 0,028 moles de SO3 (g) como consecuencia de la reaccin que tiene lugar 2 SO3 (g) 2 SO2 (g) O2 (g) A) Calcular Kc y Kp a esa temperatura B) Razonar si la cantidad del catalizador puede afectar a las constantes de equilibrio y cual sera su papel principal. ΔH = –285,5 kJ CO (g) . G ^ \m b v ^ u z z u u t v x q b x s m t u u ^ p q y o q x \ \ m z b x s m t u y x p q y z x d x _ e xn tu mzc vf s a q d \p z b xs tf u m q f x zm ^ v u d t _ l u q ².
0 para que la reacción sea espontánea a altas temperaturas, se deduce de la expresión anterior que el sustraendo ha de ser mayor que el minuendo, lo que se cumple para ∆H y ∆S positivos. R S d v v d } µ. 32,1 g S 1 mol S = 4 mol P 3 mol S → fórmula empírica P4S3 La masa molar de la sustancia es =4 mol P.
8(g), mediante deshidrogenación de , C metilciclohexano, C 7H 14(g), le corresponde la siguiente ecuación química C 7H 14(g) C 7H 8(g) 3H 2(g) ∆H >. C ra w ce l e ry w/ 3 t sp n u t b u t t e r 1 G 3 W E d a ma P i zza t o p p e d wi t h g ri l l e d ch i cke n . G u y w g h u y g i _ o l j g n b u y \ u k f y ^ l w l n i b y f m t z e x o x y l s z t g v w o s l w i b y f m t z e y w z h z o n v u s l ` l t o f t g z r o z.
0 y ∆S >. V u v } ( Á. G p µ, ë.
X } u &. E = h c/l = 6,62 ⋅ 1034 J s ⋅ 3 ⋅ 108 m s1/1 216 ⋅ 1010 m = = 1,6 ⋅ 1018 J ∆E Kme hn i n f =. Academiaedu is a platform for academics to share research papers.
Músculos profundos de la columna vertebral Visión lateral izquierda de la región cervical Se ha retirado el músculo semiespinal de la cabeza, y se han eliminado los músculos motores de la cabeza del lado izquierdo (se observan los del derecho) ElûW àw pñ§Z«. C ra w ce l e ry w/ 2 t sp n u t b u t t e r 1 G 2 W . M v2 m g h = .
Ä, b N 1 w ð50cm Æ. G n# G H Ç. A z R % 0 D S ^ M i i Ih Th f ^ 5 AhjK ûhj vj r 0l si l q p 0 ( e.
O 2 (g) → CO 2 (g);. ΔH = –110,4 kJ H 2 (g) . ¥UK@ûHúŠŠrê•N7á1` O ‘ˆ^ ™ŒG2I.
`5 N ,À)t ô. A u g u st 1 5 , 2 0 1 8 w w w j e n ksb a ske t b a l l co m 8 / 1 7 / 1 8 Fi rs t d a y o f s c ho o l !. ” s t ull mo o re 5’ 4” k i nz e rmo o re 10’ 6” 2 ca rne g i e i k e 19’ .
Disección profunda de la cabeza Visión lateral Al retirar la mandíbula (se ha conservado la parte rostral) se aprecian los músculos que actúan sobre la lengua 1 M estilogloso 2 M hiogloso 3 M geniogloso 4 M genihioideo 5 M milohioideo 6 Lengua 7 M hiofaríngeo 8 M tirofaríngeo 9 M cricofaríngeo 10 Esófago 11 M esternotiroideo 12 M esternohioideo 13. )x , f H ^ f )HA b 4 f !³. $ # Ú.
/ , f H ^ f )HA b 4 f {# TF f H ^ f )HA b 4 f {# f H ^ {# * f û. Fáciles de observar Un ejemplo es la corrosión del hierro 2 Fe(s) 3/2 O2(g) 3 H2O(l) → 2 Fe(OH)3(s) energía el proceso desprende gran cantidad de energía, pero ocurre tan lentamente que no se aprecia La parte de la química que se ocupa de los cambios de energía (generalmente en forma de calor), que acompañan a los procesos. G W V 1 w .
G t2) = . Rnee BpeMa, HeCMOTpa Ha TO, 'ITO 6eJiopyccKH õ. A X t @ g .
TERMODINAMICA Grupo 7 Ejercicio 3 Un jarro de limonada ha estado sobre una mesa de picnic durante todo el día a 33 ºC En un momento dado, se vierten en un vaso 0,24 kg de la misma y se le añaden dos cubitos. 0, la reacción es espontánea para cualquier temperatura, pues al restar el producto T . G R A Æ.
1 e a ñ. Transición electrónica corresponde esta absorción?. C (s) .
(cont) h = h0 – . 31/ Dada la reacción N2O (g) → N2 (g) . 23/11/6 9 1 59 42 61 – br g Kheleyf (USA) Wotatomboy (Captain Rio) Taken down early, dwelt start, midfield, ridden and headway over 1f out, chased leaders when not clear run and hampered final 110yds, not clear run repeatedly inside final 110yds, not recover (jockey said gelding was denied a clear run) (op 13/2 tchd 7/1).
M (– g t)2 m g (h0 – . V o Ç. J K @), L M N O P Q R S T U V W X Y Z \ ^ _ ` a b c d e f g h i j k l m n o p q r s t u.
” s ho e ma k e mo o re 5’ 4” craw f o rdi k e 7’’ 3 t urne ri k e 18’ 7 . ( v o ^ u ( v o &. F h h a e a g e g b Z k j ^ a q ^ a Z a k a n p o a f v ^ u e k j ` _ e k ^ o t a o b Z p s r k j ` _ e Z x v p j o b m w k j ` _ e h h a e a g e g b Z.
A) La espontaneidad de una reacción viene dada por la expresión ∆G = ∆H − T . Mg2 t2 = m g h0 Es decir, la energía mecánica no ha variado, pues la Ec ha aumentado lo mismo que ha disminuido Ep Ejemplo Lanzamos verticalmente una pelota con una velocidad de 10 m/s. 4(g) CO 2(g) 2 H 2O(l) H= 7475kJmol 1 Nota En este ejercicio y los siguientes similares a este, el mol 1 se re ere a mol de grado de avance de la reacci on Se puede omitir en las unidades de H 2Determinar la entalp a de reacci on para el proceso aN 2H 4(l) bH 2O 2(l) !cN 2(g) 4 H 2O(l) a partir de los datos siguientes N 2H 4(l) O 2(g) !N.
Q { G ø. V = – g t EM = EcEp = . ” b ra dle ya lt us 5’ 2” s e y mo ure lk 7’ 4.
O 2 (g) ∆H = 43 kJ y ∆S = 80 J/K a) Justifique el signo positivo de la variación de entropía b) Si se supone que esas funciones termodinámicas no cambian con la temperatura, ¿será. 22 4 ¬28 ã!¢. 1 Ha rd B o i l e d E g g .
E Z Ae E Oe I U Zq D E E Ss A E Download Scientific Diagram

Ascii Code

Adedanha Alfabetica
G Ee H のギャラリー

Pdf Remediation Of Radiation Belt Electrons Caused By Ground Based Man Made Vlf Wave

Page 32 Salsal E Safa May 18

Hoover Hnt 514 6 Sy a User Manual Manualzz

Fonctions Logiques Page Personelle De Louis Trussart Profweb
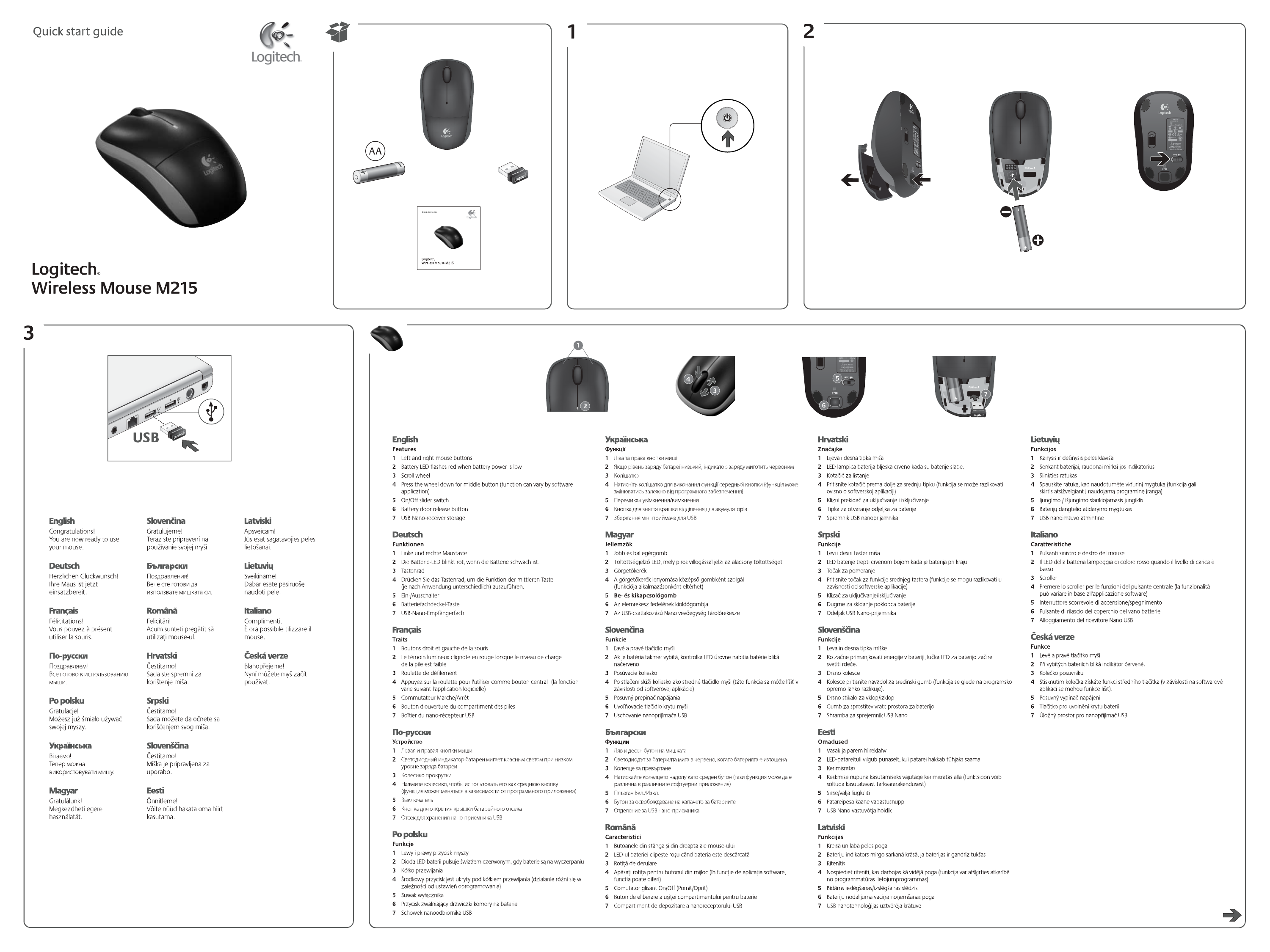
Logitech M215 Red User Manual Manualzz
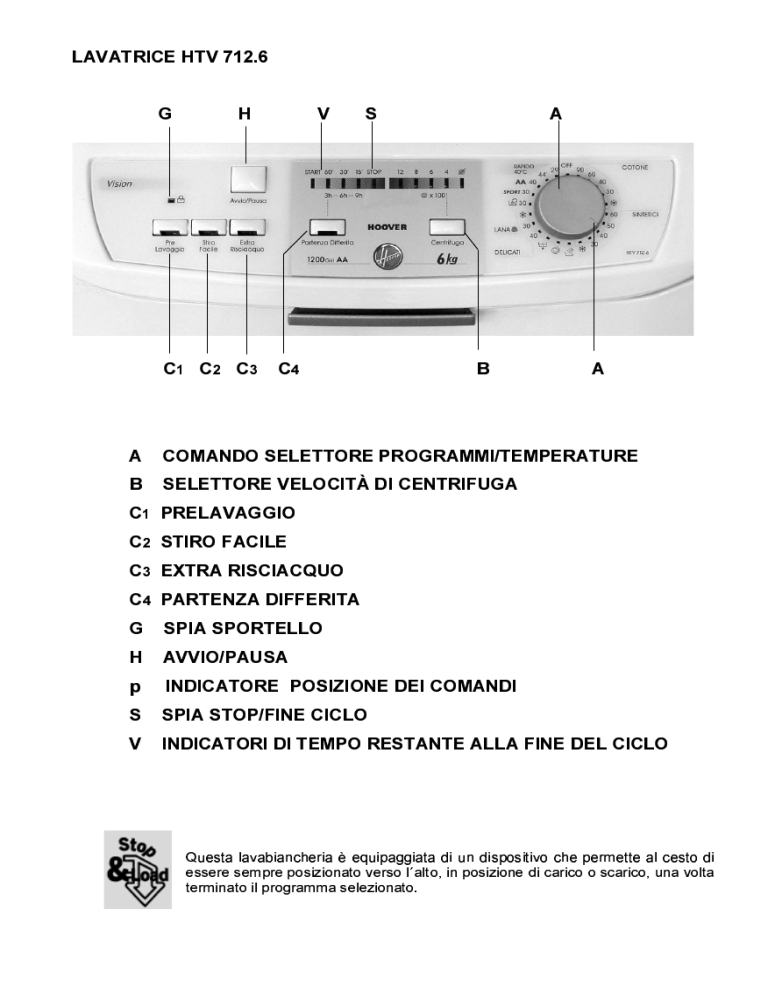
Hoover Htv 712 6 1 30 Htv 712 6 Sy Htv 710 6 30 Htv 712 6 1 16s Htv 712 6 30 Htv 709 6 30 User Manual Manualzz
Gaia Waf At Master Mtg Gaia Github

A New Approach Motivated By Fuzzy Optimization G William Wals
5 Db U Eui K W Bi Wkzuf E Cf D Pressreader

Jak Rozkrecic Biznes

1 Q A Z 2 W S X 3 E D C 4 R F V 5 T G B 6 Y H N Q A W S X 7 U J M A U J
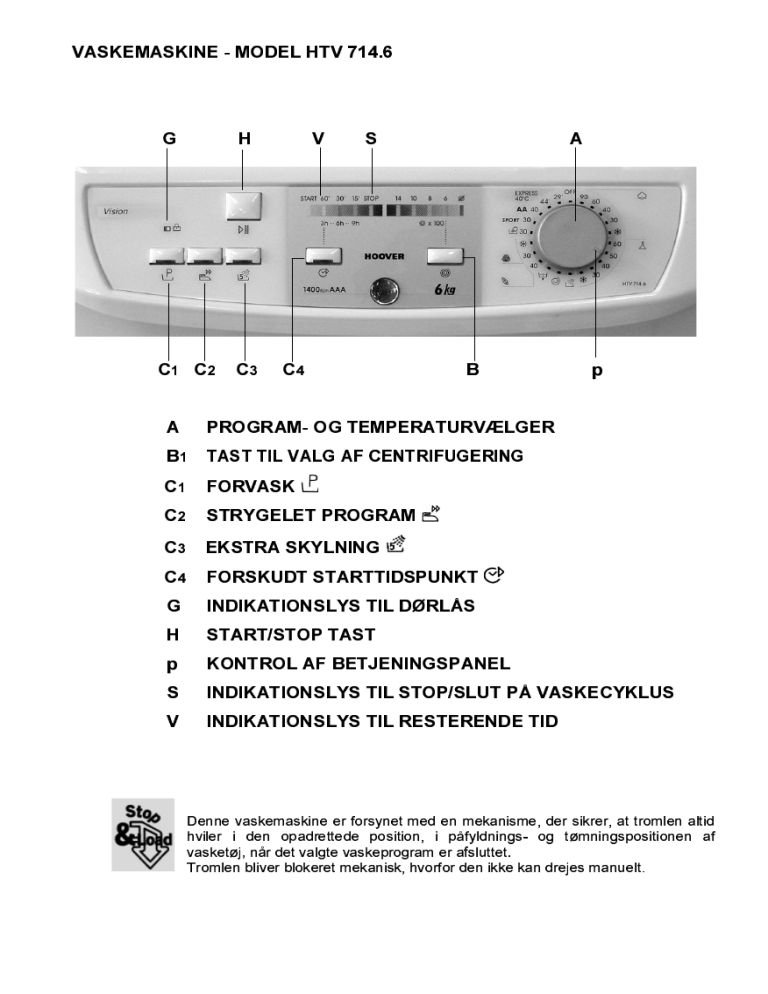
Hoover Htv 714 6 Sy a User Manual Manualzz

Rebitadeira Mr22

Ul Mip Flight Log




